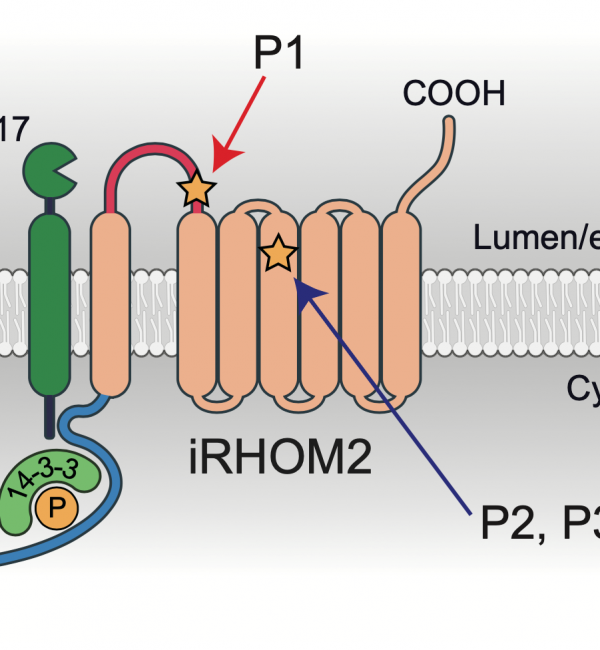
Kubo S. et al. Nat Immunol. 2021 (in press) doi: 10.1038/s41590-021-01093-y.
ヒトの病気は、遺伝と環境の両方によって規定されている。一方で、ヒト免疫におけるTNFの重要性は、最終的に自己免疫疾患に対するTNF阻害薬の劇的な効果により実証された。TNF-αは免疫細胞より膜型TNFとして産生されるが、実際には、細胞表面から切断され可溶性TNFとして放出され初めてその役割を果たす。自己免疫疾患の治療において、TNFの中和に関しては多くの報告があるが、TNFの切断および放出に関しては報告が少ない。膜型TNFはADAM17依存的に切断、放出されることが知られており、このADAM17の機能を制御するのがiRHOM2と呼ばれるプロテアーゼである。
我々は、異なる臓器で感染症を再発する2家族、4名の全ゲノムシークエンスによって、iRHOM2をコードする遺伝子であるRHBDF2の機能喪失変異を発見した。これらの患者ではiRHOM2が欠損しており、患者リンパ球におけるADAM17の活性化が低下し、TNFを含む重要なサイトカインの切断と放出が阻害されることがわかった。それに呼応して4人の患者の血清TNFは、健常者と比べて低かった。健常人リンパ球でRHBDF2をノックアウトすると、このTNF分泌の欠陥が再現され、患者リンパ球にiRHOM2を強制発現させるとその欠陥は修正された。さらに患者末梢血を用いたトランスクリプトーム解析から、iRHOM2はヒトリンパ球の機能のみならず、好中球の活性化遺伝子発現にも影響を与えることが示された。
ところが、このようにすべての患者で一様にTNFの分泌不全が起こっているにも関わらず、各個人の標的臓器は異なっていた。4名の機能喪失変異を持つ患者のうち、一人は肺炎を再発したが大腸には病変がなく、もう一人は感染性出血性大腸炎を再発したが肺には病変がなく、残りの二人は繰り返す上気道炎のみを再発した。多様な臨床表現型を理解するために、ヒトの感染症を模倣し、iRHOM2ノックアウトマウスに緑膿菌とシトロバクター・ロデンティウムを感染させた。野生型マウスと比較して、iRHOM2ノックアウトマウスは重度の肺炎を起こして死に至り、TNFの分泌が不足しているために細菌が大腸に侵入し、大腸炎を引き起こした。これらの結果は、環境因子が患者の表現型に影響していることを示唆しており、実際にこれらの患者の腸内マイクロバイオームを検討すると、再発性大腸炎を有する患者は、他の患者と大きく異なっていた。
我々はこの新しい先天性免疫不全症をiRHOM deficiency with Respiratory and Intestinal infection and cytokine Secretion defect(IRIS)と名づけ、iRHOM2が異なる粘膜部位での感染症の再発を防ぐという生物学的メカニズムを説明した。今回の結果は、IRIS患者の異なる表現型が微生物の「環境」に依存していることを示しており、微生物環境のような見過ごされがちな外的要因が、医師が臨床現場で目にするものを決定する可能性があることを示している。
「Both genes and environment define healthy and diseased phenotypes.」という一文から本論文は始まります。これは論文作成にあたり、私と私のボスであるMike Lenardo先生とのやり取りの中で決まった文でした。「病気は遺伝と環境によって規定されている」という(当たり前のような)普遍的な本質ですが、この一文に本論文で言いたいことが集約されており、この文を書いたときに投稿する前から受理されるような不思議な予感がありました。そのためか論文が受理された時はそれほど大きな驚きや喜びはありませんでしたが、ふとここでの研究生活を思い返した時、自分の中での病気に対する考え方が変わっていることに気づき、それは成長と呼べるものなのかもしれないと嬉しく感じました。Nature immunologyを書いたくらいで偉そうに、なんて言われればそれはその通りで、そもそも私一人でできた仕事でもありません。だからじゃないですが、もう一度最初から始めるつもりで、これからも臨床と研究に専念したいと思っています。