CD4+ T細胞は獲得免疫応答に必須の役割を果たすリンパ球である。定常状態下、同細胞はナイーブ(CD44lo CD62Lhi)、外来抗原特異的メモリー、および外来抗原独立性メモリー様(ともにCD44hi CD62Llo)細胞からなり、前二者は病原体に対する獲得免疫反応の中核をなすことが広く知られている(Kawabe T, et al. Cold Spring Harb Perspect Biol 13(9):a037879, 2021)。これに対し我々は、後者のメモリー様細胞が、外来抗原ではなく自己抗原認識依存的に恒常的に産生され、トキソプラズマや結核感染時にはT細胞であるにも拘わらず自然免疫的な様式で感染防御に寄与することを発見し、これを「Memory-phenotype cell: MP細胞」として報告した(Kawabe T, et al. Sci Immunol 2(12): eaam9304, 2017)。MP細胞は、NK細胞や自然リンパ球と類似の自然免疫機能を有する新たなTリンパ球として注目を集めている(Kawabe T, et al. Nat Rev Immunol 18(3): 1, 2018)。従来から知られる古典的ヘルパーT細胞の場合、同細胞はTh1、Th2、Th17等のサブセットに分類されることから、MP細胞においても同様に類似のサブセットの存在が類推され、それぞれ特有の分化機構や自然免疫機能を有する可能性が示唆される。そこで本研究では、MP細胞に含まれるサブセットを同定し、その分化機構や免疫学的機能を解明することを目的とした。
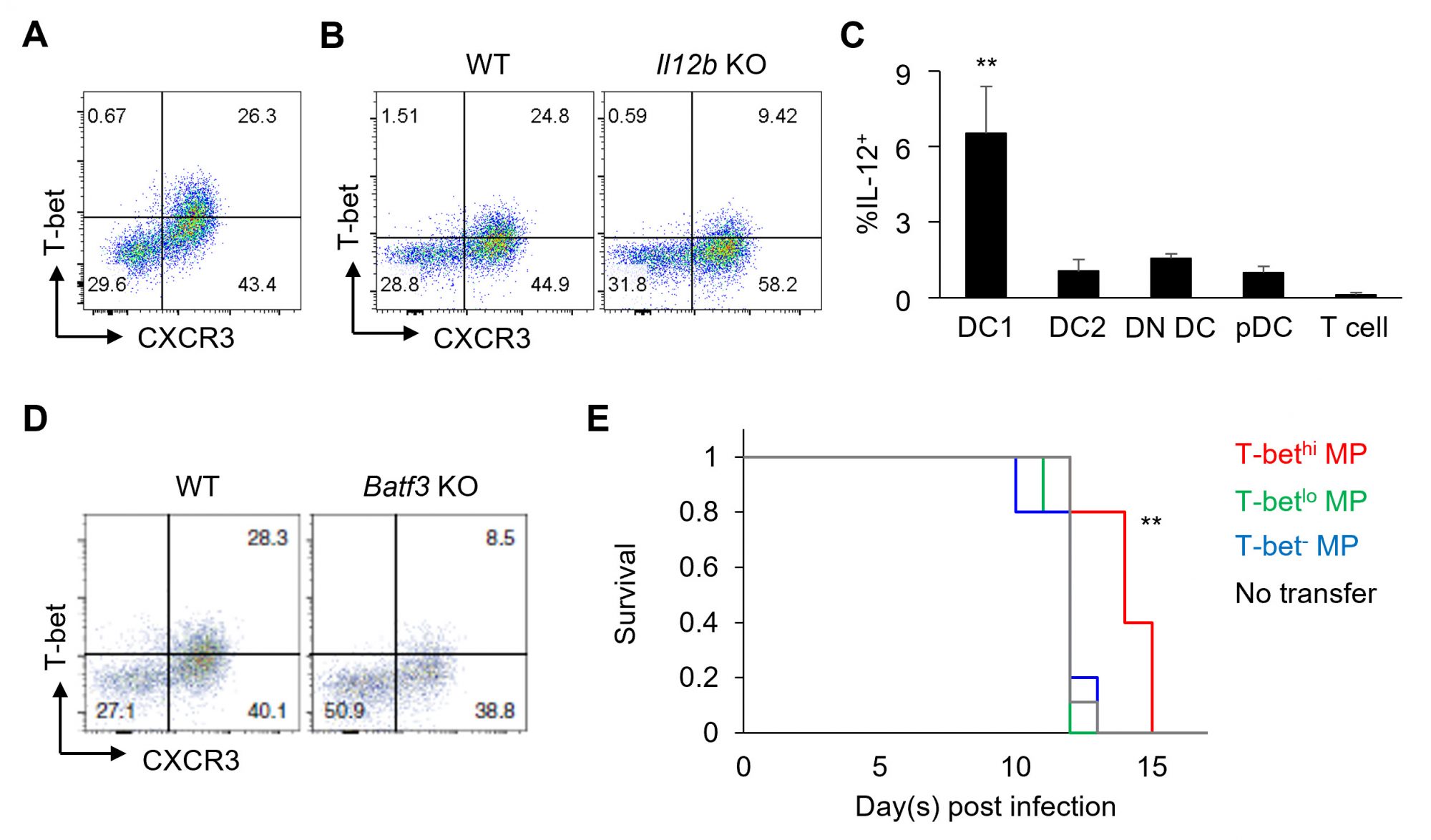
我々はまず、定常状態におけるMP細胞のT-bet、CXCR3(ともにTh1のマーカー)発現量をフローサイトメトリーにて計測した結果、同細胞はT-bethi CXCR3+の高度に分化したTh1様分画を有することが明らかになった(図1A)。通常のTh1分化の場合、LPSなどの微生物由来のアゴニストが樹状細胞のIL-12産生を促進し、同サイトカインがTh1分化を誘導する。そこで次に我々は、T-bethi CXCR3+ MP細胞の分化誘導機構を解析したところ、定常状態下、1型樹状細胞(DC1)由来のIL-12が同分化を恒常的に促進することが分かった(図1B – D)。驚くべきことに、DC1による恒常的IL-12産生には微生物構成成分は不要であり、自己由来の何らかのアゴニストが同産生を定常的に惹起しているものと考えられた(論文を参照)。更に我々は、T-bethi MP細胞の自然免疫機能を解析したところ、トキソプラズマ感染下、同細胞は抗原認識の非存在下においてもIFN-gを産生し宿主生体防御に寄与することが判明した(図1E)。
以上より、MP細胞の約30%を占めるTh1様のT-bethi CXCR3+分画はDC1由来のIL-12により恒常的に分化誘導され、病原体感染時には自然免疫的な様式で生体防御に寄与することが明らかになった。
本論文は、留学先であった米国立衛生研究所・国立アレルギー感染症研究所(National Institute of Allergy and Infectious Diseases (NIAID), National Institutes of Health (NIH))のAlan Sher博士の研究室で開始し、日本に帰国後も共同研究の形で研究を継続し、最終的に2020年、上梓に至った論文です。もともと私は、同研究所のWilliam Paul博士の研究室に留学し、新規のT細胞「MP細胞」を報告しておりましたが(Kawabe T, et al. Sci Immunol 2(12): eaam9304, 2017)、今回の論文は、このMP細胞の詳細な分化機構や機能の解明に取り組んだ論文ということになります。現在私は東北大学に異動し、研究チームをあげてMP細胞の全容解明を目指して引き続き研究に取り組んでおり(図2)、今後、ますます邁進して参りたいと存じます。最後に、私の研究をサポートしていただいております東北大学の石井直人教授、菅村和夫名誉教授、NIH・NIAIDのAlan Sher博士、William Paul博士(2015年逝去)、Ronald Germain博士、豪州Garvan InstituteのJonathan Sprent博士に心より御礼申し上げます。