GRK5 Inhibition Attenuates Cartilage Degradation via Decreased NF-κB Signalling.
Arthritis and Rheumatology. 2020 Apr;72(4):620-631.
NF-κB経路は、細胞の生存、分化、炎症などを介して変形性関節症(以下OA)の病態生理に広く関与することが報告されており、NF-κB経路を阻害する標的戦略はOA治療の有望な選択肢である。しかしながら、これまで直接的に阻害するアプローチでは臨床治療に活かせておらず、OA病態に特異的な機序を介した阻害が必要と考えた。
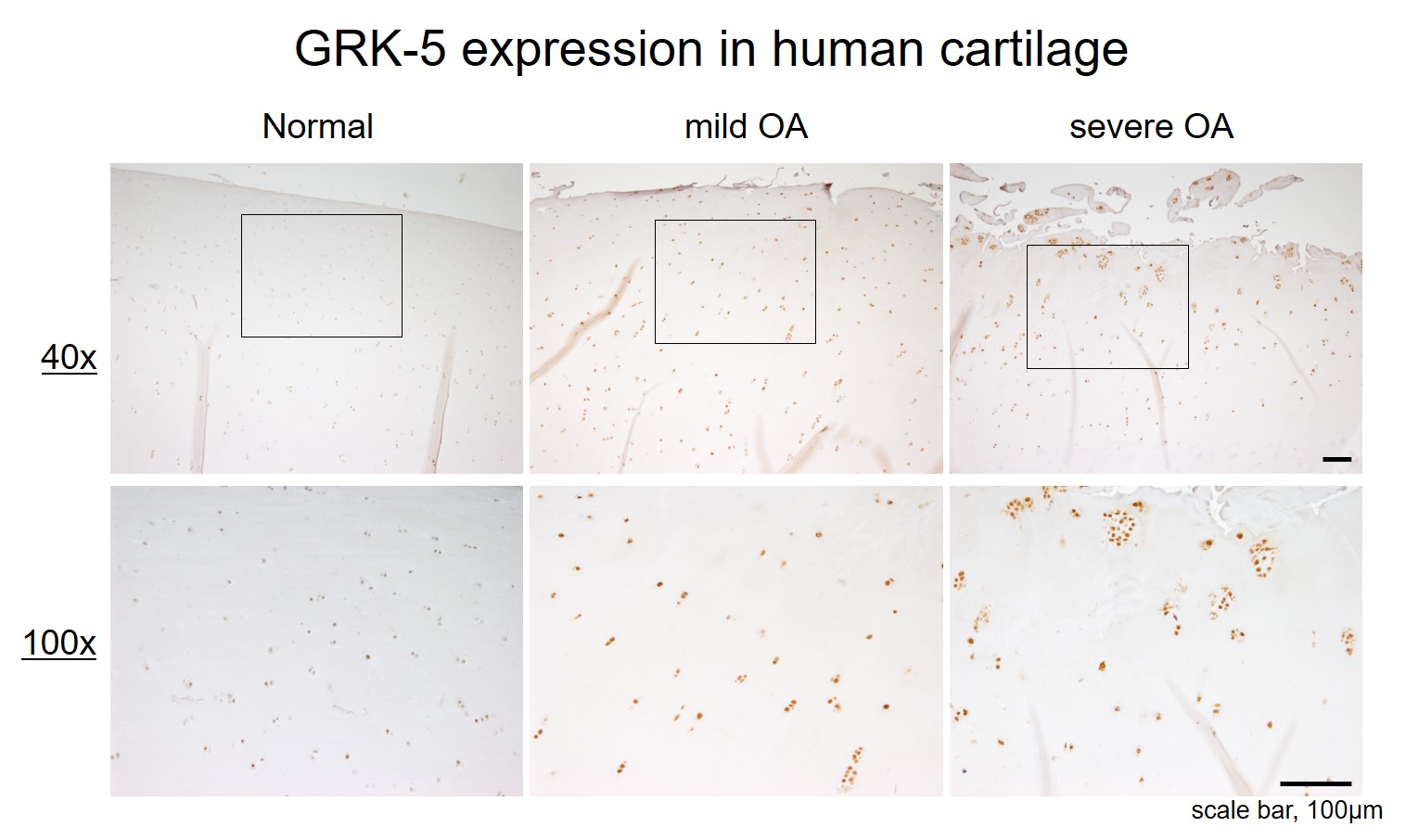
本研究で着目したG protein-coupled receptor kinase 5 (GRK5)は、全身の細胞に遍在的に発現しNF-κB シグナルの活性を正方向に制御し、心肥大、敗血症、アルツハイマー病、および癌を含む病因における重要なキナーゼであると提唱されている。さらに、自験例でヒトOA軟骨では正常軟骨と比較し、GRK5の発現が著明に亢進していたこと(図1)が本研究の発起となった。
OA病態に関与するGRK5の機能の重要性は、ヒト及びマウスの軟骨細胞を用いてgain-及びloss-of-function実験で分析した。ヒトOA軟骨細胞においてGRK5遺伝子発現を抑制させると、LPS刺激に反応するNF-κBの活性が抑えられ、その下流の炎症性因子の発現も低下した。逆にGRK5を過剰発現させると、NF-κBは活性化され、下流の因子の発現が有意に上昇した。さらに、GRK5ノックアウトマウスの軟骨細胞において、IκBαのリン酸化とp65の核への移行が減少した。これらの結果より、OA病態において特異的に発現亢進したGRK5は、NF-κBの上流で機能し、病態悪化因子であることを証明した。
続いて、GRK5がOAの病因因子であり、その阻害薬がOA治療薬となりうることを明らかにした。内側半月板前角切離によるOAモデルでは、ノックアウトマウスは野生型マウスに比し、組織学的な軟骨変性が有意に抑制された。さらに、野生型マウスのOAモデルにGRK5阻害薬であるアンレキサノクスを膝関節内に投与した結果、vehicle群に比しOAの軟骨変性進行は有意に抑制された。この結果より、GRK5阻害薬は、NF-κB経路による異化反応を介した軟骨変性を制御することによってOA治療薬となり得ることが示唆された。本研究で使用したGRK5阻害薬であるアンレキサノクスはOA治療薬における重要な化合物となる。
OAの病態因子として報告されている因子は幾多とありますが、実臨床で疾患修飾OA治療薬として製薬化まで至っているものはありません。現状では、多くの製薬企業が求めるOA治療の新薬は再生効果、すなわち変性軟骨がもとに戻る効果を期待するものです。しかしながら、OAの病態を考えると、いくら軟骨のみを再生できたとしても、再生軟骨はいずれ変性することになります。またOAにおける再生反応には有害な骨棘形成があります。アカデミアと製薬企業のギャップがOA治療において新薬が生まれにくいことの一因と考えます。例えば、関節リウマチでは次々と標的治療の新薬が市場にでてますが、主要な治療効果は寛解までの活動性の抑制効果で十分であり、再生効果は今のところ副次的なものです。OAにおいては、軟骨変性抑制、関節水腫の消失、疼痛の軽快がRAでの寛解にあたります。OAの薬物治療が進歩するには、まずはOAの進行を抑制できる治療薬の選択肢が増えること、その後に再生まで期待できる作用を探ることが必要と考えます。
本研究は、The Scrips Research Instituteでの海外留学を終え、九州大学整形外科に赴任後に最初に立ち上げた研究です。最終的な治療薬開発の可能性を念頭に、ヒト軟骨サンプルでOA軟骨に特異的な因子、遺伝子改変マウスが入手できる、治療薬となる化合物(できれば既存薬)があるという条件で見つけたのがGRK5でした。実験の大部分を担当した筆頭著者の居石卓也先生と研究グループのメンバー(図2)、ヒト軟骨を提供いただいたMartin Lotz教授のおかげで論文発表はもとより、本研究で使用したアンレキサノクスを原薬としたOA治療薬の開発につなぐことができています。医師主導治験までのロードマップの完遂によってOA新薬を世に出すことが本研究のゴールです。